实验 10:生物化学
绪论
这是一个分为三个部分的实验,在一个实验课时内完成。请确保完成所有三个部分的预实验报告。
本实验整合了生物学和化学的原理。将检验生物构建模块,特别是蛋白质和核酸的化学行为。
在 A 部分,您将了解色谱法以及它如何用于分离氨基酸混合物。
在 B 部分,您将从牛奶中分离酪蛋白Casein,并使用四种定性测试分析您的样品。在 C 部分,您将从洋葱中分离 DNA。
实验 10A:使用纸色谱法鉴定氨基酸amino acids混合物
A.1绪论
纸中的纤维素是色谱法的极佳固定相,创造性地称为纸色谱法。
在本实验中,您将使用纸色谱法分离和鉴定氨基酸混合物。
A.2理论背景
氨基酸Amino acid H₂N–CHR–COOH是有机分子,由一个碱性氨基 、一个酸性羧基 (-COOH) 和一个对每种氨基酸Amino acid H₂N–CHR–COOH都不同的有机侧链 (R) 组成。结构上:
H₂N–CHR–COOH
虽然自然界中存在一百多种氨基酸Amino acid H₂N–CHR–COOH,但只有二十种常用于生物体内的蛋白质合成。人体无法合成其中九种氨基酸Amino acid H₂N–CHR–COOH(必需氨基酸Amino acid H₂N–CHR–COOH),因此它们在饮食中必不可少。其余 11 种(非必需氨基酸Amino acid H₂N–CHR–COOH)通过称为转氨基作用的氧化还原反应合成。此外,植物含有其他非蛋白质氨基酸Amino acid H₂N–CHR–COOH,例如,它们利用这些氨基酸Amino acid H₂N–CHR–COOH来合成生物碱。
所有氨基酸Amino acid H₂N–CHR–COOH共有的特性是由于羧基 ( -COOH ) 和氨基 ( ) 基团的相对排列。每种氨基酸Amino acid H₂N–CHR–COOH特有的物理和化学性质是独特 -R 基团的结构和化学性质的结果。氨基酸Amino acid H₂N–CHR–COOH根据 R 基团的极性(在中性 pH 值下与水相互作用的倾向)和电荷进行分组。本实验中使用的氨基酸Amino acid H₂N–CHR–COOH的 R 基团列于表 1 中。
| 中文名 | 英文名 | 简写 | R基团 | 极性 | 酸碱性 | |
|---|---|---|---|---|---|---|
| 丙氨酸 | Alanine | Ala | A | CH₃ | 非极性 | 中性 |
| 天冬氨酸 | Aspartic | Asp | D | CH₂COOH | 极性 | 酸性 |
| 半胱氨酸 | Cysteine | Cys | C | CH₂SH | 极性 | 中性 |
| 亮氨酸 | Leucine | Leu | L | CH₂CH(CH₃)₂ | 非极性 | 中性 |
| 赖氨酸 | Lysine | Lys | K | (CH₂)₄NH₂ | 极性 | 碱性 |
丙氨酸 Alanine Ala A CH₃ 非极,中疏水
天冬氨酸 Aspartic acid Asp D CH₂COOH 极,酸
半胱氨酸 Cysteine Cys C CH₂SH 极,中亲水
亮氨酸 Leucine Leu L CH₂CH(CH₃)₂ 非极,中疏水
赖氨酸 Lysine Lys K (CH₂)₄NH₂ 极,碱
| 丙氨酸 (Ala) | 天冬氨酸 (Asp) | 亮氨酸 (Leu) | 赖氨酸 (Lys) |
|---|---|---|---|
表 1
纸色谱法可用于分离和鉴定合成或天然制剂中的氨基酸Amino acid H₂N–CHR–COOH。吸附在高度极性纸纤维上的水是固定相,而游离溶剂是流动相。极性组分被极性固定相吸引,因此会沿纸移动得更慢,从而实现混合物中组分的分离。
Rf=retention factor 保留因子
组分移动的距离与溶剂移动的距离之比是 值(比前沿值)。
值是溶剂和组分特性的函数。
值越接近 1.0,组分在流动相中保留越多。将未知物的 值与标准已知化合物的 值进行比较,可以帮助识别混合物中的未知组分(这些组分必须在相同条件下与标准品进行比较)。
C₆H₄–C(=O)–C(=O)–C(=O)–OH
C₆H₄–C(=O)–C(=O)–C(=O)–OH · H₂O
图 2:茚三酮 Ninhydrin C₉H₆O₄(1,2,3-三酮基茚满水合物)
氨基酸Amino acid H₂N–CHR–COOH是无色的。
因此,为了确定氨基酸Amino acid H₂N–CHR–COOH的位置,将干燥的纸用茚三酮 Ninhydrin C₉H₆O₄喷洒,茚三酮 Ninhydrin C₉H₆O₄与游离胺free amine -NH2反应,在每个氨基酸Amino acid H₂N–CHR–COOH的位置产生紫色至红棕色的斑点。
颜色和强度的变化是由于氨基酸Amino acid H₂N–CHR–COOH上茚三酮 Ninhydrin C₉H₆O₄结合位点数量的差异造成的。
A.3仪器
吹风机
A.4废弃物
用过的溶液(液体废弃物)应丢弃到指定的液体废弃物容器中。毛细管应放置在受污染的玻璃废弃物容器(蓝色垃圾桶)中。
A.5步骤
务必在整个过程中戴上手套!用手指触摸纸张可能会导致不准确的结果。
Step1
从前台获得一张 No. 2 Whatman® 滤纸。用铅笔和一把公制尺子,在上面描绘一个 的矩形。
从每条描绘的线上测量 0.5 cm,并剪掉多余的边缘。
根据下图,在底线上方画一条 2 cm 的线。
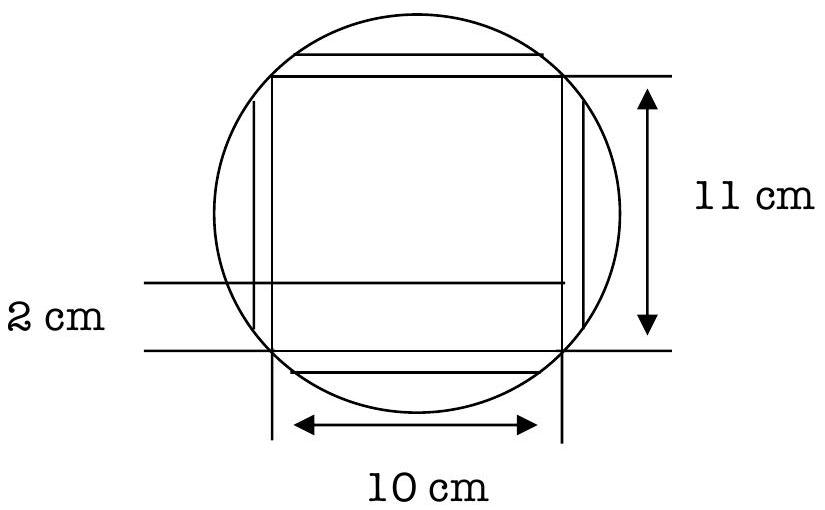
图 3
在该线上均匀地做六个标记 (x)。
将它们编号为 1 到 6
(1 代表丙氨酸,2 代表天冬氨酸,3 代表亮氨酸,4 代表赖氨酸,5 代表混合物,6 代表未知物)。
铅笔浅浅标记期望高度(约 8 cm)
Step2
将过滤纸放在一张铝箔纸上,并在过滤纸正上方,底线稍上方放置一支铅笔或钢笔,以便过滤纸表面高于工作台表面,并且过滤纸在应用样品时不会受到污染。
Step3
使用干净的毛细管将样品和未知物施加在标记 (1 到 6) 上。
小心只轻轻触摸纸张;你不想戳任何孔。
少量添加样品非常重要。
让每个样品干燥(吹风机),然后重新施加,以便将更多的样品放到纸上的小点上。
不要一次添加所有材料,因为这样做会产生一个大点。
纸张上较大的斑点会导致色谱图中每种化合物的谱带较宽。
Step4
将纸张从中心对折,使斑点在外面。
检查它是否适合你的 600 mL 烧杯。
然后在加入溶剂之前将其取出。
Step5
将 50 mL 的展开溶剂developing solvent(乙酸、1-丁醇和水)倒入 600 mL 烧杯中,并将烧杯放在通风橱下。
Stationary Phase固定相=滤纸
Mobile Phase流动相=展开溶剂developing solvent
Step6
小心翼翼地将纸张插入烧杯中,使斑点位于溶剂表面上方约 1 厘米处;只有纸张的底边应接触溶剂。用一块铝箔纸紧紧盖住烧杯口。
Step7
溶剂将开始在纸上向上移动。
让溶剂前沿在底线上方移动约 8 厘米。
Step8
从烧杯中取出纸张,并立即用浅色铅笔线标记溶剂前沿。
让纸张彻底干燥;使用吹风机冷风辅助干燥过程。
Step9
在通风橱中,用茚三酮 Ninhydrin C₉H₆O₄溶液喷洒纸张。
彩色斑点应在 15 分钟内出现。
用吹风机暖风稍微加热纸张,以便这些斑点更快地出现。
Step10
现在标记每个斑点的中心。测量纸张底部原始线和溶剂前沿之间的距离(精确到小数点后两位)。
此外,测量从底线到每个斑点中心的距离。
这些测量值用于计算 值。
A.6数据表格
数据表格必须在你的实验笔记本中。
| 样品 | 斑点距离 (cm) | 斑点颜色 | 溶剂前沿距离 (cm) |
|---|---|---|---|
| 丙氨酸 | |||
| 天冬氨酸 | |||
| 亮氨酸 | |||
| 赖氨酸 | |||
| 混合斑点 | |||
| 未知物 |
A.7撰写报告 & 计算
包含所有进行的计算的示例,以及误差分析。 此实验部分的报告单可在本文件末尾找到。
Step1
计算色谱图中每个斑点的 值。 不要忘记包括误差分析。
Step2
使用 值和已知斑点的颜色来识别未知物。
●实验 10B:酪蛋白Casein的分离和鉴定
B.1介绍
你将在等电点条件下从牛奶中分离酪蛋白Casein,并进行一些化学测试。
B.2理论背景
酪蛋白Casein是牛奶中最重要的蛋白质。 从营养上讲,牛奶是一种几乎完整的食物,含有蛋白质、脂肪、碳水化合物、许多矿物质和许多重要的维生素。 牛奶蛋白质包括酪蛋白Casein、乳清蛋白和乳球蛋白。 酪蛋白Casein约占牛奶中蛋白质的 80%,约占人乳中蛋白质的 40%。
牛奶中的酪蛋白Casein是一种磷蛋白,含有约 0.7% 的磷。 酪蛋白Casein以酪蛋白Casein酸钙的形式存在于牛奶中,以酪蛋白Casein酸钾的形式存在于人乳中。
可以通过酸化使蛋白质达到其等电点,从而从牛奶中分离出酪蛋白Casein。 等电点是蛋白质具有相等数量的正负电荷的 pH 值,使其具有整体中性电荷。 同时具有正电荷和负电荷的分子称为两性离子。
蛋白质在其等电点时在水中的溶解度最低,因为它们倾向于因静电吸引而聚集。 一个蛋白质分子的正端吸引另一个蛋白质分子的负端,直到聚集体从溶液中析出。
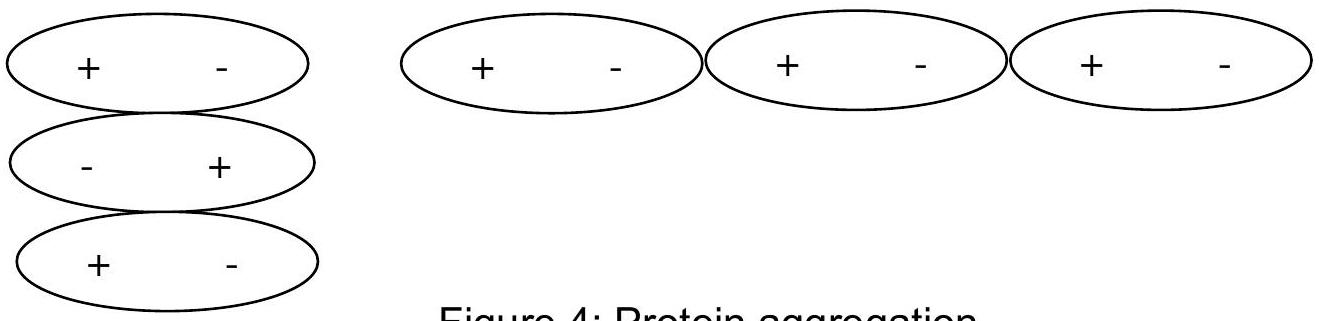
图 4:蛋白质聚集
每种氨基酸amino acids都有一个 N 端,以及一个 C 端。 因为蛋白质是氨基酸amino acids链,所以每种蛋白质都有一个 N 端=NH₂,以及一个 C 端=COOH。
图 5:氨基酸amino acids的一般结构
H₂N–CHR–COOH
如果蛋白质分子具有净正电荷(在低 pH 值、酸性条件下)或净负电荷(在高 pH 值、碱性条件下),其在水中的溶解度会增加,参见图 6。
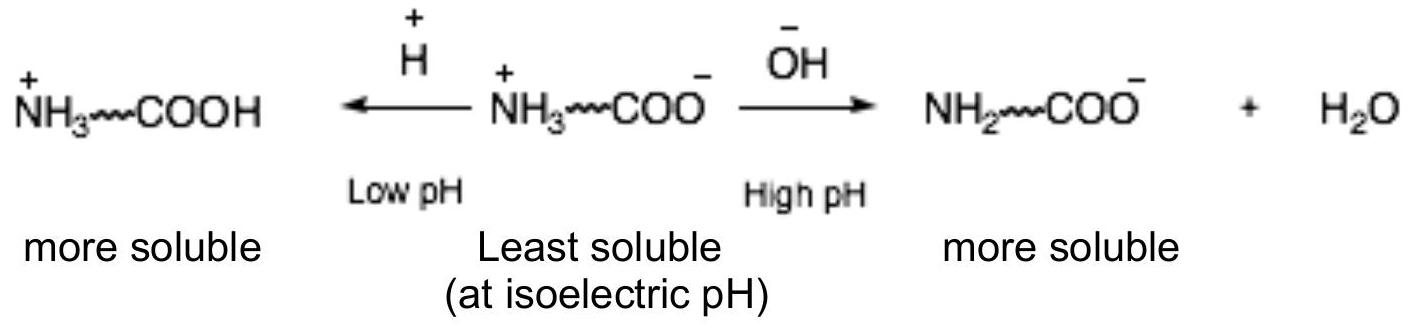
图 6:蛋白质在其等电 pH 值时溶解度最低
在本实验的第一部分中,你将从 pH 值约为 7 的牛奶中分离出酪蛋白Casein。 通过将牛奶酸化至其等电点 ,酪蛋白Casein将被分离为不溶性沉淀物。 随酪蛋白Casein一起沉淀的脂肪可以通过将其溶解在酒精中来去除。
牛奶含有多种不同类型的酪蛋白Casein。这些蛋白质形成胶束,胶束是球体,其疏水部分聚集在胶束内部,亲水部分位于外部。外部的亲水部分保持胶束在水中的溶解性。胶体磷酸钙将胶束结合在一起,并通过胶束保持溶解性。通过降低 pH 值,磷酸钙变得可溶,胶束溶解。一旦酪蛋白Casein在溶液中游离,它们就能在其等电点聚集。
接下来,您将证明沉淀的乳制品是一种蛋白质。将使用以下化学测试进行鉴定:双缩脲Biuret试验、茚三酮 Ninhydrin C₉H₆O₄试验、重金属离子试验和黄蛋白Xanthoprotein试验。
1. 双缩脲Biuret试验
这是最常用的蛋白质测试之一。蛋白质将与铜 (II) 离子反应,形成紫色的铜配合物。
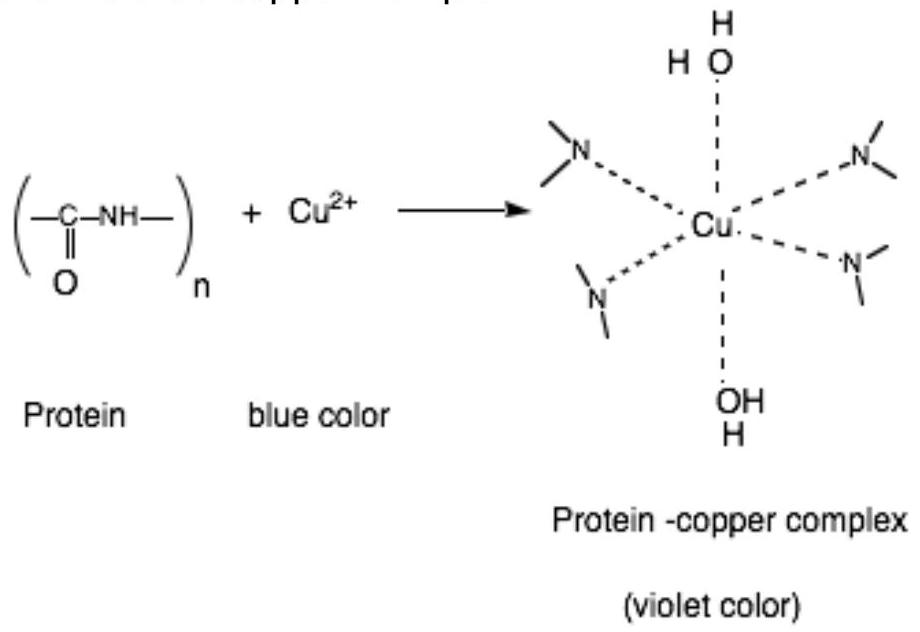
图 7:双缩脲Biuret试验
当分子中存在肽键peptide bond -CO-NH-时,即存在蛋白质时,双缩脲Biuret试验将呈阳性。
图 8
2. 茚三酮 Ninhydrin C₉H₆O₄试验
含有游离氨基 的氨基酸amino acids和蛋白质将通过与茚三酮 Ninhydrin C₉H₆O₄的反应产生阳性结果。阳性测试由溶液中的颜色变化指示。
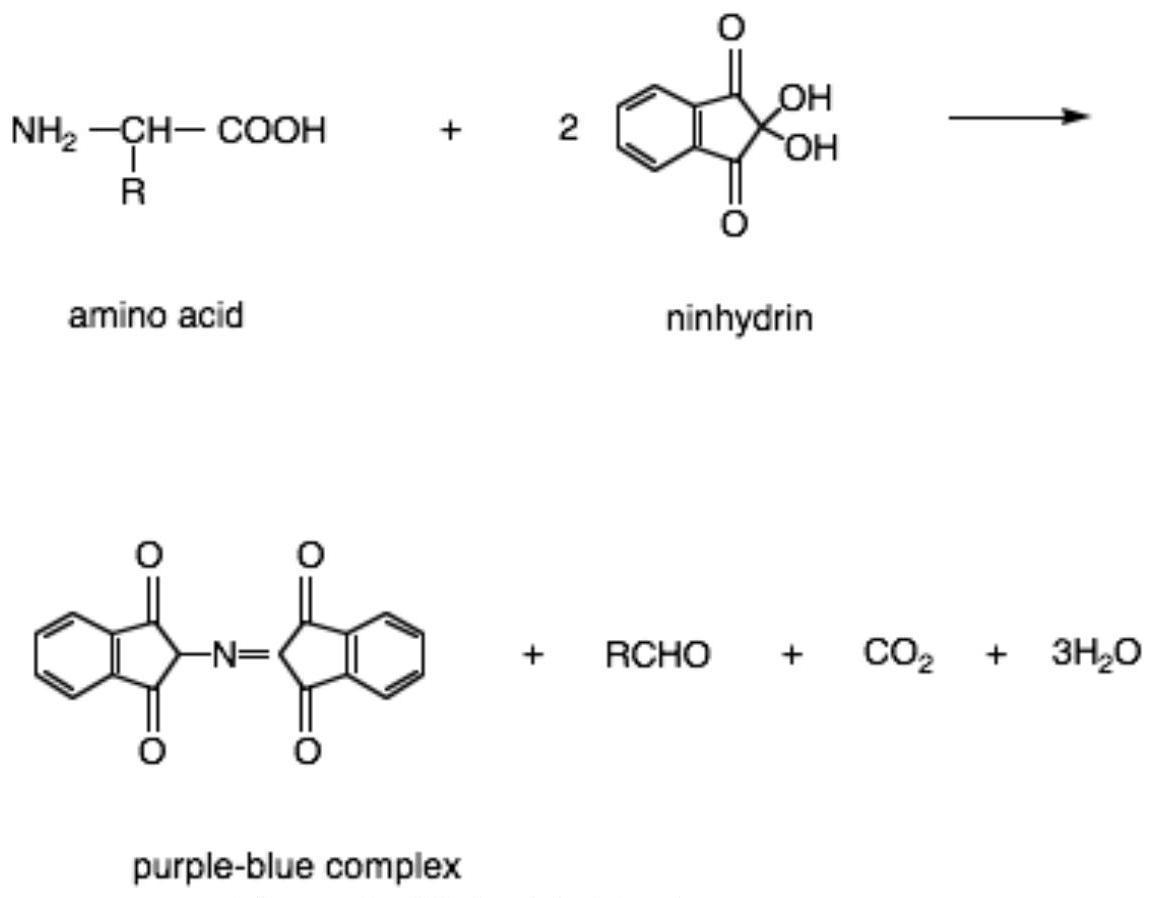
图 9:茚三酮 Ninhydrin C₉H₆O₄试验
3. 重金属离子试验
重金属离子会使蛋白质从溶液中沉淀出来。最常用于蛋白质沉淀的离子是 和 。
在这些金属离子中, 和 是臭名昭著的有毒物质。它们会通过使蛋白质(尤其是酶)变性而对蛋白质造成严重损害,从而可能导致死亡。沉淀的发生是因为蛋白质被重金属交联,如图 10 所示。
图 10:重金属试验 吞食了 或 离子的人通常会用富含蛋白质的食物作为解毒剂进行治疗。这种解毒剂可以与受害者胃中的汞或铅离子结合,有时可以防止离子的吸收。牛奶和生蛋白是最常用的。然后立即使用催吐剂(一种引起呕吐的物质)将不溶性复合物从胃中移除。重金属也会使蛋白质中的硫化物键变性。
4. 黄蛋白Xanthoprotein试验
这是分子中含苯环phenyl rings的标准测试。
浓硝酸与苯环phenyl rings反应,生成黄色或橙色的芳香族硝基化合物。加入碱会加深颜色。参见图 11。 有色化合物
图 11:黄蛋白Xanthoprotein试验
B.3仪器
电热板
B.4废弃物
所有液体废弃物必须丢弃在指定的液体废弃物容器中。
B.5步骤
B.5.1第一部分:酪蛋白Casein的分离
Step1
使用一个装有约 200 mL 自来水和磁力搅拌子的 600 mL 烧杯,设置一个水浴。
将其放在带搅拌功能的电热板上。
将加热设置为中低,搅拌速度设置为 2-3。
=建立恒温水浴系统
Step2
在 250 mL 锥形瓶中称取约 50 g 牛奶,并将锥形瓶夹在水浴中,使水高于牛奶的水平。参见图 12。
将牛奶加热至约 ,用搅拌棒频繁搅拌。
温度计不需要夹住。您应该检查牛奶的温度,而不是水浴的温度。
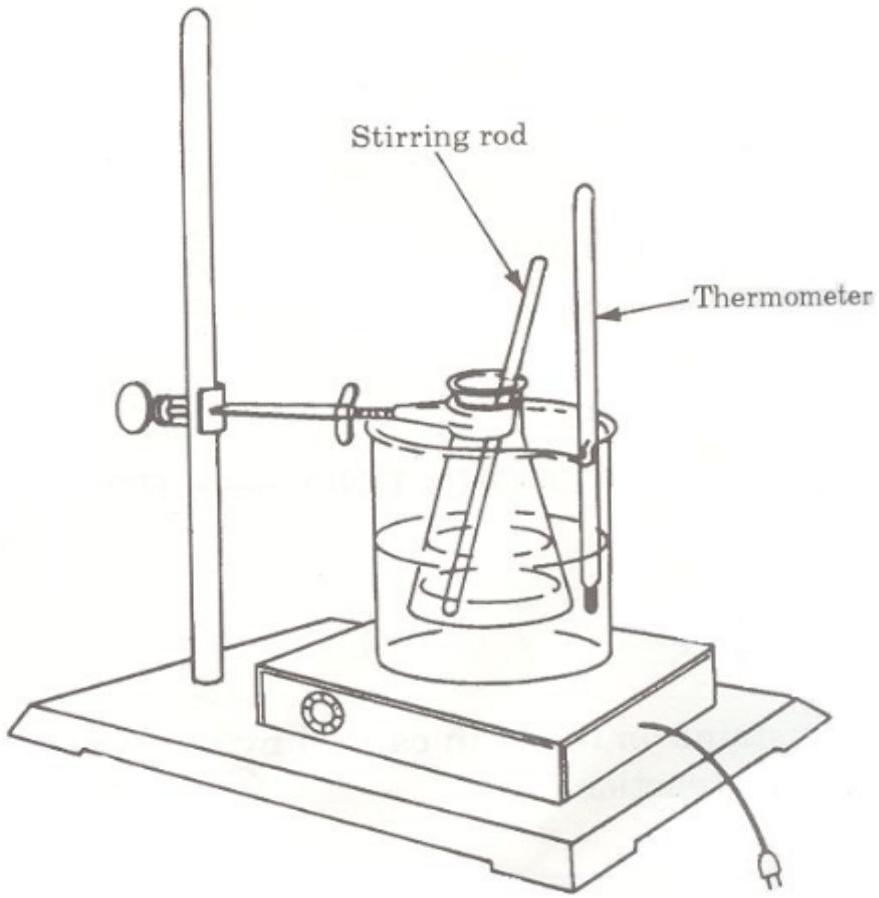
图 12:酪蛋白Casein沉淀的设置
Step3
从水浴中取出烧瓶,并在搅拌的同时加入约10滴冰醋酸glacial acetic acid。注意沉淀物的形成=酪蛋白沉淀。
Step4
用一块粗棉布Cheesecloth盖住250 mL烧杯的杯口,并用橡皮筋固定粗棉布。
稍微向下压布的中心,以便容纳你的混合物。将混合物通过粗棉布过滤到烧杯中。参见图13。
松开橡皮筋,轻轻挤压粗棉布,以去除沉淀物中的大部分液体。用刮铲尽可能地将沉淀物从粗棉布刮回空烧瓶中。
图13:酪蛋白Casein的过滤
Step5
向烧瓶中加入25 mL的95%乙醇。搅拌混合物5分钟后,让固体沉淀。
小心地将含脂肪的液体倾析到烧杯中并丢弃。
Step6
向残留物中加入25 mL的1:1乙醚:乙醇 ether:ethanol混合物,并搅拌混合物5分钟。
Step7
在大表面皿上称量一张滤纸=在进行过滤之前,将一张干净的滤纸放在一个干净、干燥的大表面皿(Watch glass)上,一起精确称重并记录质量=B.1.2. 滤纸和表面皿的质量 (g) Mass of filter paper and watch glass (g)
使用该滤纸建立真空过滤系统。过滤乙醚-乙醇ether:ethanol混合物,用少量乙醇ethanol冲洗烧瓶。
将带有残留物的滤纸放在已称重的表面皿上干燥。
Step8
称量干燥的酪蛋白Casein=将带有滤纸和干燥酪蛋白的表面皿一起进行精确称重,并记录总质量=B.1.3. 含干燥酪蛋白的滤纸和表面皿的质量 (g)=3. Mass of filter paper, watch glass and dried casein (g)
并计算牛奶中酪蛋白Casein的百分比。
B.5.2第二部分:蛋白质的化学分析
Step9
Biuret试验:
准备四个干净的试管。将以下每种溶液各15滴添加到不同的干净试管中,并标记试管。 a) 2%甘氨酸2% Glycine Gly b) 2%明胶2% Gelatin c) 第一部分制备的酪蛋白Casein(刮铲尖端大小)和15滴蒸馏水 d) 1%酪氨酸1% Tyrosine Tyr
向每个试管中加入5滴10% NaOH溶液和2滴稀释的CuSO4。充分混合。
如果出现紫红色表明存在蛋白质。记录任何观察结果。
Step10
茚三酮 Ninhydrin C₉H₆O₄试验:
准备另外四个干净的试管。将以下每种溶液各15滴添加到不同的干净试管中,并标记试管。 a) 2%甘氨酸2% Glycine Gly b) 2%明胶2% Gelatin c) 第一部分制备的酪蛋白Casein(刮铲尖端大小)和15滴蒸馏水 d) 1%酪氨酸1% Tyrosine Tyr
向每个试管中加入5滴茚三酮 Ninhydrin C₉H₆O₄试剂。充分混合。将试管在沸水浴中加热约5分钟。记录任何观察结果。如果在加热后没有反应,加入5滴10% NaOH溶液并重新加热。
在B部分(酪蛋白)中,茚三酮测试可能不太稳定,因为它依赖于pH值。如果在加热后没有看到任何颜色变化,您应该向每个试管中加入几滴NaOH(aq),然后重新加热。这应该有助于引起颜色变化。此外,该实验中常见的颜色是黄色和橙色/棕色yellow and orange/brown,这都被认为是阳性结果。
Step11
重金属离子试验:将一些牛奶(无需测量)转移到两个干净的、标记的试管中。将以下每种金属离子滴加几滴到相应的试管中,如下所示: a) Pb2+,以Pb(NO3)2的形式,加入到1号试管中 b) Na+,以NaNO3的形式,加入到2号试管中
Step12
黄蛋白Xanthoprotein试验:(在通风橱中进行实验)
准备四个干净的试管。将以下每种溶液各15滴添加到不同的干净试管中,并标记试管。 a) 2%甘氨酸2% Glycine Gly b) 2%明胶2% Gelatin c) 第一部分制备的酪蛋白Casein(刮铲尖端大小)和15滴蒸馏水 d) 1%酪氨酸1% Tyrosine Tyr
向每个试管中加入10滴浓HNO3。充分混合。小心地将试管在温水浴中加热。观察颜色的任何变化。
B.6数据表格
数据表格必须在你的实验笔记本中。
B.6.1第一部分:酪蛋白Casein的分离
Step1
牛奶的质量 ___g
Step2
滤纸和表面皿的质量 ___g
Step3
滤纸、表面皿和干燥酪蛋白Casein的质量 ___g
B.6.2第二部分:蛋白质的化学分析
| Biuret试验 | 观察结果 |
|---|---|
| 2% 甘氨酸 | |
| 2% 明胶 | |
| 酪蛋白Casein+水 | |
| 1% 酪氨酸 |
| 茚三酮 Ninhydrin C₉H₆O₄试验 | 观察结果 |
|---|---|
| 2% 甘氨酸 | |
| 2% 明胶 | |
| 酪蛋白Casein + 水 | |
| 1% 酪氨酸 |
| 重金属试验 | 观察结果 |
|---|---|
| 使用 | |
| 使用 |
| 黄蛋白Xanthoprotein试验 | 观察结果 |
|---|---|
| 甘氨酸 | |
| 明胶 | |
| 酪蛋白Casein + 水 | |
| 酪氨酸 |
B.7报告撰写 & 计算
包含每种类型计算的示例。 本实验这部分的报告单可在文件末尾找到。
注意:无需误差分析,但请用正确的有效数字报告所有答案。 计算干燥酪蛋白Casein的质量。 计算牛奶中酪蛋白Casein的百分比。
●实验 10C:从洋葱中提取 DNA
C.1介绍
脱氧核糖核酸 (DNA) 是一种存在于所有生物细胞中的大分子。它包含存在于每个活细胞中的遗传信息,是生命的遗传“蓝图”。 本实验室的目的是让您通过从植物组织中分离 DNA 来获得第一手的 DNA 经验。您将从整个洋葱开始,最终得到相对纯净的 DNA制备物,其中包含数百万个基因。一旦分离出来,DNA 就可以储存在酒精中或干燥。
C.2理论背景
DNA(脱氧核糖核酸)是构成染色体chromosomes的分子。染色体中决定特定特征的部分称为基因。在结构上,DNA 是双螺旋结构double helix;两条遗传物质链相互缠绕。
每条 DNA 链都由一个主链组成,其中糖与磷酸phosphates交替,并且每个糖上都连接着一个核苷酸碱基a nucleotide base。每个碱基(也称为核苷酸)是四种分子之一:腺嘌呤、鸟嘌呤、胞嘧啶和胸腺嘧啶。。
腺嘌呤 Adenine A
胸腺嘧啶 Thymine T
鸟嘌呤 Guanine G
胞嘧啶 Cytosine C
图 14:核苷酸碱基
两条 DNA 链通过氢键在每个碱基处成对连接:腺嘌呤 (A) 只会与胸腺嘧啶 (T) 配对,鸟嘌呤 (G) 只会与胞嘧啶 (C) 配对。 这样,一条 DNA 链可能看起来像这样:
A-A-C-T-G-A-T-A-G-G-T-C-T-A-G 图 15 与之结合的互补 DNA 链看起来像这样:
T-T-G-A-C-T-A-T-C-C-A-G-A-T-C
综上所述,DNA 片段可以表示为:
T-T-G-A-C-T-A-T-C-C-A-G-A-T-C
A-A-C-T-G-A-T-A-G-G-T-C-T-A-G
图 17 DNA 链以特定方向读取,从顶部(称为 5' 或“五端”)到底部(称为 3' 或“三端”)。 在双螺旋结构中,链以相反的方向运行。
从5开始到3结束,头尾对应
5' T-T-G-A-C-T-A-T-C-C-A-G-A-T-C 3'
3' A-A-C-T-G-A-T-A-G-G-T-C-T-A-G 5'
图 18 所有 DNA 的化学结构是相同的。 两个人或任何两种动物或植物之间唯一的区别是碱基对base pairs的顺序和数量。 每个人的 DNA 中都有数百万个碱基对,这使得每个人都有不同的序列(同卵双胞胎除外)。 使用这些序列,每个人都可以仅通过其碱基对的序列来识别。 然而,由于有数百万个碱基对,这项任务将非常耗时。 相反,科学家使用一种基于识别 DNA 中重复模式的更短方法。
C.3实验描述
DNA 的分离是生物技术中许多实验室程序的第一步。 在本实验室中,您将从洋葱组织中提取 DNA。 在本实验中使用洋葱是因为它的淀粉含量低,可以清楚地看到 DNA。
DNA存在于真核细胞中由膜包裹的细胞核内。细胞膜和核膜由脂类和蛋白质组成。机械搅拌会打破细胞,释放其内容物,包括细胞核。
去污剂十二烷基硫酸钠(SDS)通过破坏将脂类和蛋白质结合在一起的键,导致细胞膜和核膜破裂。然后,去污剂与脂类和蛋白质形成复合物,导致它们从溶液中沉淀出来。
DNA的糖和磷酸盐成分(骨架)都易溶于水,因此这将有助于使用SDS去污剂分子去除DNA。DNA外部的磷酸基团带有负电荷。这些负电荷被阳离子(如钠)吸引并中和。添加到DNA中的钠会形成一个保护性的“壳”,使其保持在水溶液中。因此,DNA将溶解在SDS中,而蛋白质和脂类将沉淀,从而可以通过过滤进行分离。
由于DNA在乙醇(酒精)中的溶解度极低,因此向过滤后的溶液中添加冷乙醇会使DNA沉淀。
在室温下,DNA开始在DNA酶(一种使DNA变性的酶,存在于细胞提取物中)的作用下变性。为了防止DNA分解,必须在冰上进行提取程序。
洋葱DNA
- 添加匀浆溶液 - 分解洋葱细胞,以便将内容物释放到溶液中。
- 由于骨架上的负电荷(磷酸基团),DNA将很容易溶于H₂O
- 加入乙醇以诱导沉淀,因为DNA在乙醇中的溶解度低于在水中
- 使用冷乙醇,因为DNA的溶解度较低
- 始终戴手套
- 手上的DNase是一种切割DNA的酶
- 切割的DNA将更难分离
C.4材料和仪器
以下材料将由每个学生小组共享: 搅拌机 新鲜的白色洋葱 砧板 刀 冰 天平 保存在冰上的95%乙醇
以下材料是每对学生需要的: 塑料手套 50 mL匀浆介质 水浴 温度计 粗棉布 2个100 mL量筒(一个保存在冰上) 一个250 mL、两个600 mL和一个1000 mL烧杯 玻璃搅拌棒
以下化学品是制备匀浆介质所必需的: 十二烷基硫酸钠(SDS) 氯化钠NaCl 柠檬酸钠 Sodium citrate 乙二胺四乙酸(EDTA) 匀浆介质homogenizing medium将提前准备好,并在实验室中提供给您。
C.5废弃物
用过的溶液(液体废物)应丢弃在指定的液体废物容器中。
C.6步骤
务必在整个过程中佩戴手套!丁腈手套可以防止您手上DNA酶将洋葱DNA切割成小片段。切割后的DNA更难收集。
在将DNA从洋葱组织的细胞核中释放出来之前,必须首先分解细胞壁和细胞膜。此步骤可以通过在搅拌机中匀浆洋葱组织来完成。
去污剂溶液通过破坏将细胞膜结合在一起的极性相互作用来破坏细胞膜,并乳化细胞的脂类和蛋白质。
然后,可以将DNA与染色体蛋白分离,因为匀浆介质会导致蛋白质从溶液中沉淀出来,但DNA不会。
本部分实验需要你在洋葱DNA的提取过程中获得分数。离开实验室前,请务必向助教展示你提取得到的DNA。
Step1
戴上手套,将中等大小的洋葱切成不大于5 mm的立方体。手套可以防止您手上DNA酶将DNA切割成小片段。
Step2
称取25 g切碎的洋葱。将所有称量的材料转移到600 mL烧杯中。
Step3
向切碎的洋葱中加入50 mL匀浆介质Homogenization Medium,
并将烧杯在水浴中孵育15分钟(不要超过!)。
热处理软化洋葱组织,使匀浆溶液能够渗透。
加热还可以使许多可能干扰分离程序的酶变性。
Step4
在冰浴中(1000 mL 烧杯中的冰水混合物)将您的制备物快速冷却至15-20°C。
此步骤应在大约6分钟内完成,以防止DNA变性。
Step5
将冷却后的制备物倒入搅拌机中,盖紧盖子。
以低速匀浆 45 秒,然后以高速匀浆 30 秒。
匀浆破坏细胞,释放其内容物(碳水化合物、蛋白质、脂肪和核酸)。
Step6
将搅拌机中的匀浆倒入 600 毫升烧杯中(如果烧杯已满,一些泡沫可以留在搅拌机中)。
让其在冰浴中静置 15-20 分钟。
Step7
将匀浆通过一层粗棉布过滤到 250 毫升烧杯中,注意将泡沫留下=不要让泡沫进入烧杯。
DNA 的沉淀:
匀浆应仅包含 DNA 和匀浆介质的成分。
在匀浆中剩余的成分中,只有 DNA 不溶于冰冷的乙醇。因此,匀浆介质的所有成分都保持在溶液中,只有 DNA 除外。
如果仔细按照说明操作,以使 DNA 的分子结构保持完整,则遗传物质genetic substance应沉淀为一种厚的、有弹性的白色团块,可以通过将其缠绕在玻璃棒或木棍上来提取。
如果 DNA 受到损坏,它仍然会沉淀,但会沉淀为一种白色、蓬松的团块,不易收集。
Step8
将装有过滤后的匀浆的烧杯放入冰浴中。让其冷却至 10-15℃。
Step9
用冷的量筒量取 80 毫升****冰冷的乙醇。
缓慢地将冰冷的乙醇沿烧杯边缘加入,直到出现白色、有弹性的 DNA沉淀物。
可能需要少于 80 毫升的酒精才能使 DNA 沉淀。
Step10
将有弹性的 DNA 缠绕或卷绕在玻璃棒或木棍上,方法是在 DNA烧杯中仅沿一个方向旋转棒。
在烧杯中以大圆圈移动棒时,继续旋转棒。
Step11
如果要保存 DNA,请小心地将其从玻璃棒末端滑入装有乙醇的小瓶中。
确保盖子足够紧,以防止泄漏。
匀浆介质的制备 <br> (该溶液将在实验室为您提供。)
| 十二烷基硫酸钠 (SDS) | 50.000 克 |
| 氯化钠 | 8.770 克 |
| 柠檬酸钠 | 4.410 克 |
| 乙二胺四乙酸 (EDTA) | 0.292 克 |
将蒸馏水添加到上述材料中,制成 1 升溶液,供 10 个小组使用。不要冷藏,否则 SDS 会使溶液变成不透明的白色。如果匀浆介质在任何时候变冷,它会变成白色,但这不会影响其功能。
重要信息:
Step1
乙醇必须是冷的,此过程才能起作用。在实验开始时,将一瓶乙醇和一个量筒放入冷却器中。确保乙醇瓶上的盖子略微松动,并且瓶子没有完全装满。
Step2
戴上手套,不要触摸容器内部,因为您手中的 DNA酶会将 DNA 切割成小片段,使其在实验结束时无法缠绕。用蒸馏水冲洗所有玻璃器皿。
Step3
仔细按照说明操作,因为温度和时间对于此过程至关重要。
Step4
用砂纸划伤玻璃棒的末端将有助于 DNA 在缠绕时粘附到棒上。不要用手指触摸棒的末端。
Step5
将提供小瓶和乙醇,以便您可以保存您的 DNA。
●C.7数据表格
数据表格必须在您的实验笔记本中。
为此部分实验创建您自己的数据表格。
C.8撰写与计算
此部分实验不需要计算,但您会因分离洋葱 DNA 而获得分数。离开实验室前,请务必向您的助教展示您分离出的 DNA。
废物处理
所有溶液、试剂和混合物都需要倒入通风橱下的液体废物容器中(确保没有水性铅离子被倒入下水道)。
所有带有化学残留物的玻璃器皿(试管、烧杯、烧瓶等)应按照EPA清洗技术,用少量去离子水冲洗3次,然后丢弃到液体废物容器中。可以在水槽中用水以及必要时使用清洁剂进行额外的清洗。玻璃试管(用水冲洗后)可以放入可回收玻璃箱(白色纸板箱)。
塑料移液管应放置在房间前部的塑料废物容器中。
真空过滤的滤纸以及用过的粗棉布应放入实验室前部的固体废物容器中。